Resumen
Las micotoxinas son metabolitos secundarios de los hongos, las cuales son las responsables de la generación de micotoxicosis en los animales. Encuestas recientes donde se han evaluado muestras de 4 continentes y más de 30 países muestran una alta frecuencia de micotoxinas en el maíz, siendo positivas con al menos una micotoxina, el 92% de las muestras analizadas. Las micotoxinas generan serias afectaciones al sistema inmune de las aves, hígado, riñón, sistema nervioso, entre otros. Es por esto por lo que un control adecuado con atrapantes de micotoxinas, con suficiente soporte científico en cada especie y subespecie y modo de acción, es fundamental a la hora de escoger este tipo de soluciones. Este artículo pretende dar un panorama general del conocimiento actualizado sobre micotoxinas, ocurrencia mundial, efectos sobre las aves y soluciones para este problema que no solo afecta a los animales sino a los humanos también.
Palabras clave: semillas, granos, micotoxicosis, salud intestinal, microbiota, salud hepática.
Micotoxinas aspectos generales
La primera micotoxina descrita, Aflatoxina B1 (AFB1), fue descubierta en el año de 1965. Desde esa fecha, se han publicado a la fecha de este artículo, más de 55.000 manuscritos científicos en Pubmed (www.pubmed.gov). Los datos son contundentes en mostrar la significancia y el impacto de las micotoxinas no solo en los animales, sino en humanos, volviéndose un problema de salud global y de seguridad e inocuidad alimentaria, el cual es ignorado en países de bajos ingresos donde las micotoxinas afectan los alimentos básicos de la canasta familiar tales como el maíz, trigo y el maní [1]. La exposición a las micotoxinas es a largo plazo y frecuentemente en altas dosis, a pesar de que algunas regiones en particular son mínimamente reguladas en términos de prácticas agrícolas y exposición humana.
Solamente se ha prestado atención en naciones con poder adquisitivo alto, las cuales exigen, y además tienen regulaciones estrictas sobre la contaminación por micotoxinas [2]. A la fecha, la salud tanto humana como animal, requiere más información confiable basada en la evidencia sobre micotoxinas, así como biomarcadores de exposición confiables y datos de estudios de distribución mundial, los cuales permiten establecer programas de control eficaces y reducción de exposición en poblaciones vulnerables [3]. La implementación de técnicas para la remoción de micotoxinas más prácticas y asequibles que reduzcan su exposición, cada vez cobran más relevancia. Una vez las micotoxinas son ingeridas, estas llegan al tracto gastrointestinal interactuando directamente con la microbiota, alterando la homeostasis intestinal y por eso se vuelven tan nocivas para el hospedero [4, 5].
Es importante hacer énfasis en que la sola presencia del hongo no implica la producción de micotoxinas y que las micotoxinas pueden estar presentes aun en ausencia de granos dañados visualmente. Otro concepto importante es la sinergia versus aditividad, ya que el efecto negativo combinado sobre la productividad y la salud es aparentemente mucho mayor que la suma de sus efectos individuales.

Que son las micotoxinas?
El término micotoxina viene del griego “mykes” que significa hongo y “toxicon” que significa veneno. Es decir, hongo y veneno, respectivamente. Las micotoxinas son metabolitos secundarios de bajo peso molecular (~ 700 Da), altamente nocivos. Ellas afectan negativamente varios órganos como el hígado, sistema inmune, sistema nervioso y también directamente a la célula, afectando la expresión génica ya que es capaz de unirse al ADN y posteriormente producir aductos de ADN (segmentos de ADN unidos a una sustancia química que causa cáncer. Este proceso podría ser el inicio de una célula cancerosa o carcinogénesis).
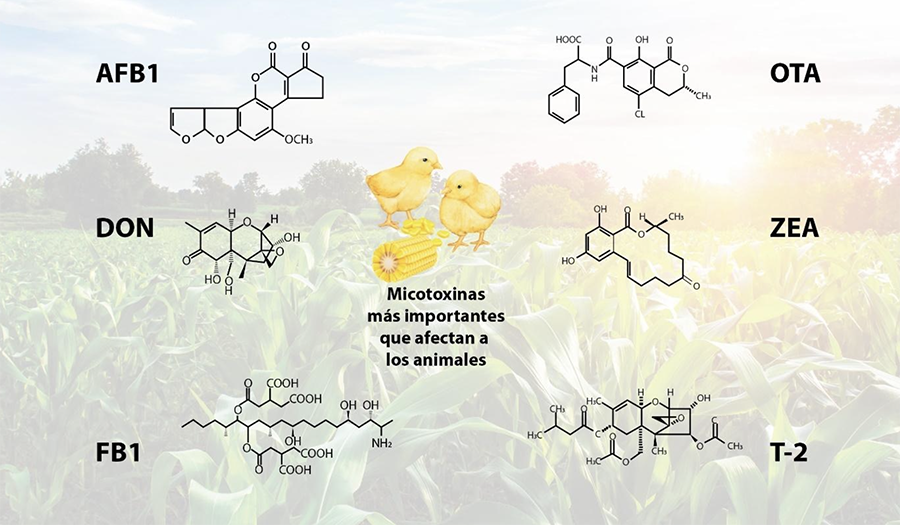
Son químicamente muy estables, resistentes a la temperatura, al almacenamiento y a las condiciones del proceso. Tienen su origen en hongos filamentosos llamados mohos, como Fusarium sp, Aspergillus sp, Penicillium sp y que no son esenciales para su crecimiento. Se producen en ambientes favorables, en la mayoría de las materias primas en todo el mundo. Se han identificado más de 400 tipos de micotoxinas a la fecha, siendo las más importantes Aflatoxina B1 (AFB1), Fumonisina B1 (FB1), Deoxinivalenol (DON), Ocratoxina A (OTA), Zearalenona (ZEN), Toxina T2 (T2), debido a su afectación en la productividad y salud de las aves (Figura 1).
El crecimiento de los hongos y la formación de micotoxinas es dependiente de múltiples factores ambientales, entre los cuales se pueden mencionar: estación del año, condiciones tropicales, ubicación del cultivo, sequedad y tiempo de cosecha [6]. Además, los procesos deficientes posteriores a la cosecha, almacenamiento inapropiado, condiciones de transporte no óptimas, procesamiento y mercadeo, pueden contribuir con el crecimiento de los hongos e incrementar el riesgo de mayor cantidad de alimento con mohos conteniendo alta concentración de micotoxinas [7].
La forma estructural de las micotoxinas varía de 4 simples compuestos C como por ejemplo moniliformina a sustancias complejas como las fomopsinas [8].
Abreviaturas: FB1: Fumomisina B1, DON: Deoxinivalenol, OCT: Ocratoxina, ZEA: Zearalenona, T2: Toxina T2, AFB1: Aflatoxina B1, AOH: Alternariol, AME: Alternariol metil eter. *Algunas especies pueden ser de cultivo también.
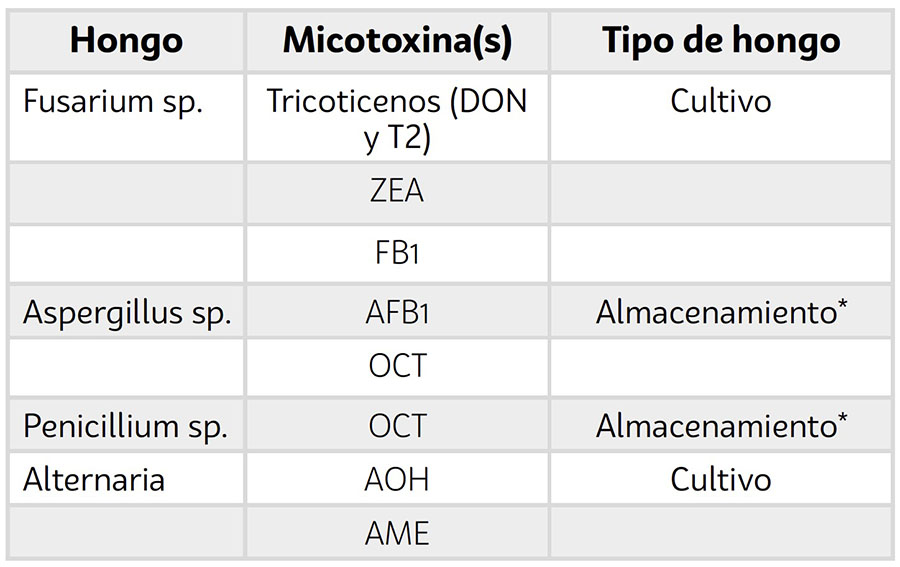
Cuando se habla del origen de las micotoxinas se debe considerar tres procesos claves como el cultivo, la cosecha y el almacenamiento. El tipo de hongo que afecta las diferentes semillas y la calidad de los granos, se pueden clasificar en dos grupos ecológicos: hongo de campo y hongo de almacenamiento, lo cual está relacionado con si la infección sucede antes o después de la cosecha. Los hongos de campo invaden las semillas y granos antes de la cosecha cuando las semillas se desarrollan en plantas madre del campo o una vez ya están maduras. Dichos hongos requieren un contenido de humedad “en equilibrio” con una humedad relativa de mínimo 90-95%. Esta medida equivale al concepto de actividad de agua (o en inglés activity water, aw) el cual es el criterio preferido para medir el contenido de humedad y corresponde a la humedad relativa del aire en equilibrio con las semillas dividido por 100. En otras palabras, es la cantidad de agua disponible para el crecimiento de microorganismos como los mohos. Los hongos de campo no incrementan en número con el almacenamiento. Ejemplos de ellos son:
Alternaria, Fusarium, Cladosporium o Helminthosporium (Bipolaris/Deschlera) [9]. Los hongos de almacenamiento invaden las semillas durante el almacenamiento como su nombre lo dice. No están en proporciones significativas antes de la cosecha. El principal hongo de almacenamiento pertenece al género Aspergillus y Penicillium que están presentes en semillas con contenidos de humedad relativa entre 65-90% (Tabla 1). Se estima que el 95% de las micotoxinas se producen en el campo.
El origen de las micotoxinas está estrechamente relacionado con el tipo de hongo (Tabla 1).
Ocurrencia y efectos peligrosos o dañinos
Debido a la naturaleza ubicua de los hongos, las micotoxinas se han vuelto un problema de salud pública en entidades no gubernamentales donde su ocurrencia en alimentos no puede ser ignorada ya que posee un riesgo inminente a los consumidores humanos. Dicho en otras palabras, es un problema de salud pública y de seguridad e inocuidad alimentaria [10]. La Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) declaró que el 25% de los alimentos para humanos y animales incluyendo cereales que se producen anualmente, pueden estar contaminados con micotoxinas. Sin embargo, esta cifra podría estar subestimada, dado que la ocurrencia por encima de niveles detectables ha alcanzado niveles de contaminación con toxinas entre 60-80% [11, 12].
Manejo del riesgo de micotoxinas
Un programa de manejo del riesgo de micotoxinas debe incluir los siguientes aspectos: condiciones de almacenamiento, muestreos adecuados, evaluación de materias primas y alimento terminado, y por último pero no menos importante, la aplicación de soluciones para las micotoxinas (atrapantes) [13]. Adaptar la cosecha de forma tal que no se obtengan granos dañados, ya que dichos granos son más susceptibles a la infección que los granos sanos o intactos.
Limpiar el polvo y mugre de los silos antes de almacenar los granos porque estos son frecuentemente una fuente de contaminación. Mantener el maíz a máximo 14% de humedad durante el almacenamiento. El maíz que visualmente está mohoso no puede ser almacenado por períodos largos. Una vez el maíz está seco debe ser enfriado y promover la aireación, humedad y temperatura constante. También, debería existir un programa documentado y escrito de control de plagas especialmente con control de insectos. Los parámetros de control en el silo (contenido de agua, temperatura y presencia de mohos) deberían llevarse a cabo cada dos semanas. La aplicación de fungicidas en la bodega y que estén permitidos por la regulación, aunque no está demostrado que pueda generar o reducir la concentración de micotoxinas, puede actuar de manera preventiva en la generación de nuevas micotoxinas [14].
El muestreo para el control de micotoxinas es clave. Se considera un arte más que una metodología, ya que la distribución de las micotoxinas en los cereales y en alimento terminado es bastante desuniforme y la importancia de seguir un protocolo estadístico para tomar muestras representativas se vuelve fundamental [15]. Además, su distribución es no paramétrica (no sigue distribución normal), por lo cual los promedios no son confiables como medida de tendencia central. Cuando se lleva a cabo este proceso, se debería seguir las recomendaciones consignadas en la regulación europea (EC/401/2006) sobre métodos de muestreo y análisis para el control oficial de niveles de micotoxinas en materias primas y alimentos. De acuerdo con dicha metodología, el tamaño de muestras colectadas dependerá de la cantidad del material [16].
Para la determinación de niveles de micotoxinas tanto en materias primas como en alimento terminado, existen varias técnicas las cuales se dividen en: técnicas en sitio rápidas (generalmente con equipos portátiles), métodos de tamizaje rápidos (ELISA) y las altamente específicas, sensibles y confiables como la cromatografía líquida con espectrometría de masas (LC-MS/MS).
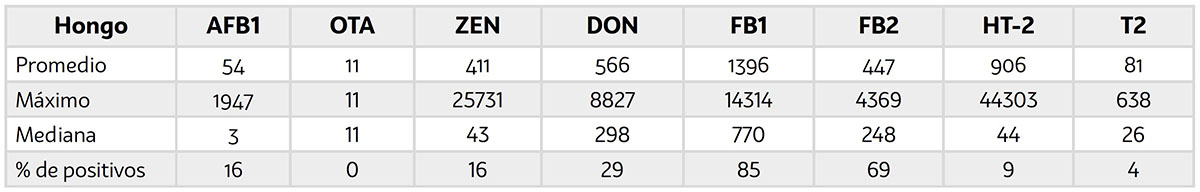
Las encuestas sobre la ocurrencia de micotoxinas dan una aproximación sobre la frecuencia de cada una de las micotoxinas, de acuerdo con la región de donde se reciben las muestras. Recientemente se llevó a cabo una evaluación para tamizar muestras de maíz recibidas de diferentes países y regiones del mundo (un total de 4 continentes representados con más de 30 países con un n=1000 muestras por año), entre septiembre del 2020 y febrero del 2021. Se buscaba determinar el nivel de contaminación por micotoxinas y entender la ocurrencia y co-ocurrencia de micotoxinas. Las muestras se analizaron por LC-MS/MS usando el método para la detección de multi-micotoxinas (AFB1, OTA, DON, FB1, FB2, ZEA, T-2 y HT-2) para cuantificación de todas las micotoxinas presentes en cada muestra. Los resultados mostraron que el 92% de las muestras estuvieron contaminadas con al menos una de múltiples micotoxinas y solo el 8% estuvieron libres de micotoxinas (Tabla 1). Los resultados más relevantes fueron: Alta predominancia de micotoxinas del hongo Fusarium (FB1, FB2, DON, ZEN), y alta co-ocurrencia de micotoxinas (aproximadamente el 75%) e independientes de la región global (Europa, África, Asia, Latinoamérica, otros países) [12].
Abreviaturas: AFB1: Aflatoxina B1, DON: Deoxinivalenol, OTA: Ocratoxina A, ZEA: Zearalenona, FB1: Fumomisina B1, FB2, Fumomisina B2, T2: Toxina T2, HT-2: Toxina HT-2.
Efectos de las micotoxinas en avicultura
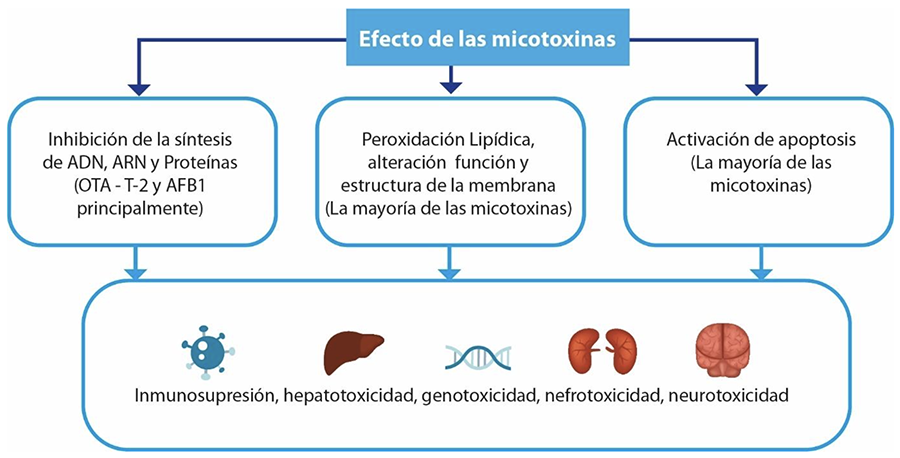
En la Figura 2 se resumen los principales efectos de las micotoxinas en las aves. Las principales que afectan las aves son: AFB1, OTA, FB1 y Tricoticenos (T-2, diacetoxiscirpenol o DAS y DON).
Se ha reportado que AFB1 ocasiona una afectación en la ganancia de peso ocasionando animales desuniformes, baja productividad y pérdida de apetito [17]. De igual manera se ha reportado hepatomegalia, daño hepático e hígados pálidos, así como desórdenes en sistema nervioso central (más en patos y pavos). También se ha observado signos como debilidad en patas y alas relajadas (pollo de engorde), alteraciones de la coagulación, alteraciones en el metabolismo de la vitamina B y aminoácidos e inmunodepresión [17].
OTA la cual es bastante resistente a la temperatura y es muy difícil de remover del alimento, es nefrotóxica, hepatotóxica, teratogénica, inmunotóxica y enterotóxica. Las aves son más sensibles a OTA y tienen una tasa de absorción más baja. Tiene alta afinidad por el intestino, el cual se vuelve un órgano blanco estratégico para esta micotoxina [5]. Produce riñones agrandados y pálidos y se ha demostrado que afecta negativamente la producción de huevo ocasionando caídas en postura y en calidad de huevo [18]. OTA también afecta los procesos de absorción y de digestión, la integridad de la barrera intestinal, la inmunidad y la microbiota intestinal. Además, OTA ocasiona disbiosis y translocación bacteriana lo cual ocasiona un insulto e irritación en intestino y en otros órganos [18].
FUM afectan negativamente el desempeño, incrementan la desuniformidad, disminuyen la eficiencia alimenticia y la ganancia de peso. Además, reducen el porcentaje de huevos producidos por ave alojada, fertilidad e incubabilidad y reduce la pigmentación. A bajas dosis, incrementan la relación esfinganina a esfingosina en pollo de engorde [4]. Esta tasa es un importante biomarcador en orina o suero para evaluar la exposición a FUM ya que FB1 es un inhibidor de la N-acetil transferasa esfinganina [19].
T-2 tiene efectos tóxicos que ocasionan citotoxicidad, genotoxicidad, modulación del metabolismo, inmunotoxicidad, hepatotoxicidad, toxicidad gastrointestinal y esquelética, nefrotoxicidad, toxicidad reproductiva y neurotoxicidad. Los signos más típicos en las aves de la T-2 son las úlceras en lengua así como diarrea, anemia y mal plumaje [20].
Control de micotoxinas
La forma más común de reducir las micotoxinas del alimento contaminado es con el uso de atrapantes de micotoxinas [21]. Tienen como objetivo inhibir la ingesta de micotoxinas por el animal ya que actúan como una esponja química que absorbe las micotoxinas en el tracto gastrointestinal y por ende previene la distribución a los órganos blanco [22].
Cuando se trata de seleccionar un adsorbente de micotoxinas y ante la inmensa oferta en el mercado de este tipo de productos, es importante tener en cuenta lo siguiente: Capacidad de adsorción, desempeño de amplio espectro, desorción e irreversibilidad, velocidad de absorción, especificidad/disponibilidad de nutrientes esenciales para el animal, seguridad y estabilidad, mejoramiento del desempeño zootécnico y viabilidad económica.
Los atrapantes de micotoxinas más frecuentes son de tres tipos: Inorgánicos, Orgánicos y Mixtos. Dentro de los inorgánicos, se pueden mencionar el carbón activado, atrapantes de minerales (clinoptilolita, bentonitas, caolín). Los orgánicos son de tipo glucomananos esterificados (Saccharomyces cerevisiae), resinas (Colestiramina), Enzimas (Eubacterium), extractos de algas. Las mezclas son combinaciones de ambos orgánicos y/o inorgánicos.
Se ha demostrado que algunos atrapantes previenen las pérdidas en desempeño en gallinas ponedoras expuestas a OTA. También, mejoran el bienestar y la salud de las gallinas [22]. Otra investigación mostró que en pollos de engorde desafiados con AFB1 y OTA a niveles bajos, el uso de atrapantes evidenciaron un mejoramiento en el desempeño productivo y una reducción de niveles de micotoxinas en tejidos ante desafíos concomitantes de OTA y AFB1 [23]. En esta misma línea, fue demostrado que OTA y T-2 afectaron negativamente los parámetros productivos y sanguíneos al igual que el rendimiento en canal en pollos de engorde. No obstante, la adición de un agente detoxificante a dosis entre 1-3 kg por tonelada de alimento en las dietas contaminadas, mitigaron los efectos adversos observados en productividad y salud en pollos de engorde [24].
Control de micotoxinas
Las micotoxinas pueden causar problemas de salud en animales, los cuales son promovidos por alimentos contaminados y estrés fisiológico. Esto desencadena bajo consumo de alimento y ganancia de peso, al igual que baja eficiencia alimenticia, mayores descartes y pérdida de rentabilidad. El control de las micotoxinas, al igual que otros contaminantes, mejoran el desempeño del alimento al igual que el bienestar de las aves. No existe una solución definitiva para este problema, sin embargo, se han identificado varios criterios que deben ser considerados a la hora de seleccionar un atrapante de micotoxinas idóneo. El conocimiento profundo de dichos productos, un adecuado y suficiente conocimiento científico, así como técnico, permitirá tomar la mejor decisión para permitirle expresar todo el potencial genético a las aves y obtener la mejor rentabilidad de la operación avícola.
Referencias
- Wild CP, Gong YY. Mycotoxins and human disease: A largely ignored global health issue. Carcinogenesis 2009; 31: 71–82.
- Battilani P, Stroka J, Magan N. Foreword: Mycotoxins in a changing world. World Mycotoxin J 2016; 9: 647–651.
- Bennett J, Klich M. Mycotoxins. Clin Microbiol Rev 2003; 16: 497–516.
- Liew WPP, Mohd-Redzwan S. Mycotoxin: Its impact on gut health and microbiota. Front Cell Infect Microbiol; 8. Epub ahead of print 2018. DOI: 10.3389/fcimb.2018.00060.
- Grenier B, Applegate TJ. Modulation of intestinal functions following mycotoxin ingestion: Meta-analysis of published experiments in animals. Toxins (Basel) 2013; 5: 396–430.
- Murugesan GR, Ledoux DR, Naehrer K, et al. Prevalence and effects of mycotoxins on poultry health and performance, and recent development in mycotoxin counteracting strategies. Poult Sci 2015; 94: 1298–1315.
- Khazaeli P, Najafi M, Bahaabadi G, et al. Evaluation of aflatoxin contamination in raw and roasted nuts in consumed Kerman and effect of roasting, packaging and storage conditions. Life Sci J 2014; 10: 578–583.
- Mohd-Redzwan S, Jamaluddin R, Abd-Mutalib MS, et al. A mini review on aflatoxin exposure in Malaysia: Past, present, and future. Front Microbiol 2013; 4: 1–8.
- Martín I, Gálvez L, Guasch L, et al. Fungal Pathogens and Seed Storage in the Dry State. Plants 2022; 11: 1–25.
- Jahanian E. Mycotoxin-induced toxicity; an updated mini-review on the current concepts. Immunopathol Persa 2016; 2: 11–14.
- Eskola M, Kos G, Elliott CT, et al. Worldwide contamination of food-crops with mycotoxins: Validity of the widely cited ‘FAO estimate’ of 25%. Crit Rev Food Sci Nutr 2020; 60: 2773–2789.
- Raj J, Farkaš H, Jakovčević Z, et al. Comparison of multiple mycotoxins in harvested maize samples in three years (2018–2020) in four continents. Food Addit Contam 2022; 39: 599–608.
- Binder EM. Managing the risk of mycotoxins in modern feed production. Anim Feed Sci Technol 2007; 133: 149–166.
- Sharma R, Asrani RK, Station R. Mycotoxicosis and its control in poultry : A review. J Poult Sci Technol 2014; 2: 01–10.
- Miraglia M, De Santis B, Minardi V, et al. The role of sampling in mycotoxin contamination: An holistic view. Food Addit Contam 2005; 22: 31–36.
- COMMISSION REGULATION (EC). Laying down the methods of sampling and analysis for the official control of the levels of mycotoxins in foodstuffs. Off J Eur Union.
- Cheng Y-L, Lee C-Y, Huang Y-L, et al. Aflatoxins: Their Toxic Effect on Poultry and Recent Advances in Their Treatment. In: Mycotoxins – Impact and Management Strategies, pp. 125–147.
- Zhai S, Zhu Y, Feng P, et al. Ochratoxin A: its impact on poultry gut health and microbiota, an overview. Poult Sci 2021; 100: 101037.
- Qiu M, Liu X. Determination of sphinganine, sphingosine and Sa/So ratio in urine of humans exposed to dietary fumonisin B1. Food Addit Contam 2001; 18: 263–269.
- Li SJ, Zhang G, Xue B, et al. Toxicity and detoxification of T-2 toxin in poultry. Food Chem Toxicol 2022; 169: 113392.
- Mil T De. Safety of Mycotoxin Binders Regarding Their Use With Veterinary Medicinal Products in Poultry and Pigs:an in vitro and pharmacokinetic approach. 2016; 198.
- Vasiljević M, Marinković D, Milićević D, et al. Efficacy of a modified clinoptilolite based adsorbent in reducing detrimental effects of ochratoxin a in laying hens. Toxins (Basel); 13. Epub ahead of print 2021. DOI: 10.3390/toxins13070469.
- Raj J, Vasiljević M, Tassis P, et al. Effects of a modified clinoptilolite zeolite on growth performance, health status and detoxification of aflatoxin B1 and ochratoxin A in male broiler chickens. Br Poult Sci 2021; 62: 601–610.
- Riahi I, Ramos AJ, Raj J, et al. Effect of a mycotoxin binder (MMDA) on the growth performance, blood and carcass characteristics of broilers fed ochratoxin a and T-2 mycotoxin contaminated diets. Animals; 11. Epub ahead of print 2021. DOI: 10.3390/ani11113205.